Elementární procesy v plazmatu
Jak již bylo řečeno, plazma je kvazineutrální plyn složený z iontů, elektronů a neutrálních atomů. Každá z těchto složek může interagovat s ostatními a také sama se sebou. Těmito interakcemi se budeme zabývat v této kapitole. Elementární procesy v plazmatu můžeme rozdělit na pět hlavních typů. Jsou to:
- Ionizace molekul.1
- Disociace molekul.
- Vznik a zánik negativních iontů.
- Rekombinace molekul.
- Iont-molekulové reakce.
1 V této kapitole se budeme držet anglické notace, tedy pod pojmem molekuly rozumíme atomy a molekuly. V klasickém českém pojetí musí být molekuly dvou- a víceatomové.
Popis elementárních procesů v plazmatu
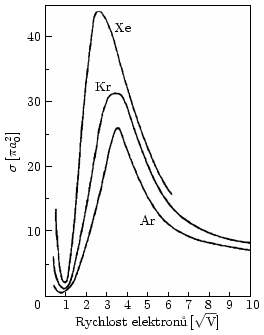
Interakci částice s látkou můžeme popsat pomocí účinného průřezu interakce σ. Jeho rozměrem je metr čtvereční a v plazmatických aplikacích se často uvádí v násobcích πa02, kde a0 je Bohrův poloměr (a0 = 0,592 Å). Účinný průřez je konstantou úměrnosti v rovnici
| (1) |
kde dI je počet částic reagujících na délce dx, N je koncentrace terčíkových center v látce a I je proud nalétávajících částic (m-2s-1). Řešením rovnice (1) je pokles proudu nalétávajících částic po průletu vzdálenosti x látkou:
| (2) |
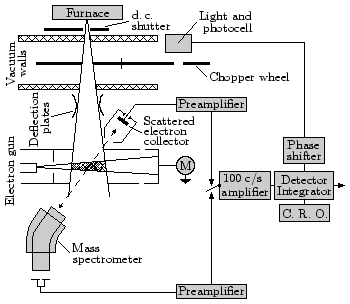
Způsob měření účinného průřezu si můžeme jednoduše představit na měření účinného průřezu ionizace neutrálního plynu elektrony. Mezi elektrodami máme neutrální plyn a do něj střílíme elektronovým dělem elektrony s přesně nastavenou energií. Ionizované molekuly neutrálního plynu vytváří proud mezi elektrodami, který můžeme změřit a získat tak účinný průřez ionizace pro danou energii elektronů. Tato závislost nás velmi zajímá, jelikož elektrony v plazmatu mají Maxwell-Boltzmannovo energetické rozdělení a můžeme tedy určit, jak budou s neionizovanými molekulami celkově reagovat.
Tento jednoduchý experiment má mnoho složitějších modifikací. Můžeme například mít paprsek elektronů a paprsek neutrálních částic křížící se v jednom bodě a měřit směry a energie elektronů i vzniklých iontů. Hmotovým spektrometrem můžeme zjistit i typy vzniklých iontů.
Popis reakce částice s látkou pomocí účinného průřezu je typický pro mikroskopický popis plazmatu. Pro makroskopický popis se lépe hodí popis pomocí rychlostní konstanty reakce (reakčního koeficientu). Ten určuje rychlost změny koncentrace částic A reagujících s částicemi B
| (3) |
kde NA a NB jsou koncentrace a k je rychlostní konstanta. (Je to rovnice binární reakce, tj. reakce záleží jen na dvou typech částic, třeba na elektronech a iontech.) V plazmatu je velmi jednoduché změřit koncentraci elektronů pomocí Langmuirovy sondy. Například rychlost rekombinace iontů a elektronů po vypnutí výboje ve výbojce tedy určíme z naměřeného poklesu koncentrace elektronů v čase a ze znalosti faktu, že koncentrace elektronů je rovna koncentraci iontů Ne = Ni.
Ionizace molekul
1) Ionizace elektronem
Zdánlivě jednoduchý typ ionizace, ale elektron může molekulu nejen ionizovat, ale i excitovat, nebo u víceatomových molekul, třeba i rozbít. Každý z těchto dějů má složité a jen obtížně měřitelné závislosti na energii, které je nutné znát (změřit nebo někde zjistit).
| Ar + e- (E1) → Ar+ + e- (E2) + e- (E2) |
Pro víceatomové molekuly vzniká více kanálů s teplotně závislým procentuálním rozložením produktů:
| CH4 → CH4+ + 2e-, |
| CH4 → CH3+ + H + 2e-, |
| CH4 → CH3+ + H- + e- |
| … a mnoho dalších kanálů ionizace. |
2) Ionizace molekulou
Molekula s dostatečnou kinetickou energií může ionizovat jinou molekulu. Je-li jedna z molekul v excitovaném elektronovém stavu (nebo je v metastabilním stavu), jedná se o Penningovu ionizaci a proces ionizace je pak mnohem pravděpodobnější.
| X* + Y → X + Y+ + e-, |
Existuje také asociativní ionizace molekulou:
| X* + Y → XY+ + e-. |
3) Ionizace pozitivním iontem
Proces typu:
| H3+ + CO → HCO+ + H2. |
4) Ionizace fotonem
Proces typu:
| X + hν → X+ + e-. |
5) Termická ionizace
I při pokojové teplotě jsou některé molekuly vzduchu ionizovány. To je způsobeno přirozenou radiací, kosmickým zářením a termickou ionizací. Obsazení energetických hladin v molekulách elektrony má pravděpodobnostní charakter (Fermi-Diracovo rozdělení), který je závislý na teplotě T. I při pokojové teplotě je nenulová pravděpodobnost výskytu plně ionizovaných molekul. Při vyšších teplotách se podíl termicky ionizovaných molekul zvyšuje.
Disociace molekul
Existuje více typů disociace molekul. Zde uvedeme příklad disociativní rekombinace a disociativní ionizace. Oba procesy mohou probíhat s elektronem nebo s molekulou jako s druhým reaktantem.
| AB+ + e- → A + B |
| X*+ AB → X + A+ + B |
Vznik a zánik negativních iontů
Existence stabilních záporných iontů, tj. iontů, které mají o jeden elektron víc než normální atom, není na první pohled samozřejmá. Proč by měl elektron obíhat kolem neutrálního atomu a tvořit tak s ním záporný iont? Kvantová (a i klasická) mechanika nabízí řešení, kdy energetická bilance takového iontu je skutečně výhodnější než bilance neutrálního atomu. Většina atomů (a molekul) tvoří záporné ionty. Energie nutná k odnesení dodatečného elektronu z takového iontu se nazývá elektronová afinita a je tabelována. Záporné ionty zanikají dodáním této energie. Třeba pomocí photodetachmentu („vyražení“ přebytečného elektronu fotonem):
| O- + hν → O + e-. |
Rekombinace molekul
K rekombinaci iontů dochází buď na stěnách, kam ionty samovolně difundují a kde buď získají nebo ztratí elektron, nebo v objemu. V objemu dochází k rekombinaci iont-iontové a iont-elektronové:
| X+ + e- → X, |
| X+ + Y- → XY. |
K úspěšnému průběhu obou reakcí je nutné splnění zákonů zachování energie a hybnosti obou reaktantů, což rekombinaci ztěžuje. Ve vesmírném prostoru například atomární vodíkový kladný iont téměř nerekombinuje. Když potká elektron, má vzniklý atomární vodík moc energie a ihned se ionizuje zpět do původního stavu. Aby tato rekombinace proběhla, musela by se jí účastnit třetí molekula, která by odnesla přebytečnou kinetickou energii.
Iont-molekulové reakce
Iont-molekulové reakce jsou obrovskou samostatnou kapitolou elementárních procesů v plazmatu. Jejich studiem se zabývá obor nazvaný plazmochemie. K popisu iont-molekulových reakcí se používá hlavně rychlostí konstanta reakce. Iont-molekulové reakce dělíme na unimolekulární:
| N2+ (v=7) → N2+ (v=2) → N2+ (v=0) |
| A+ + B → C+ + D |
| A+ + B + M → C+ + D + M, |
Závěrem
V tomto článku jsme probrali některé elementární procesy v plazmatu. Nezabývali jsme se jejich fyzikálním principem ani průběhem, přesto je naprosto evidentní, že v plazmatu se toho děje hodně, a že pro experimentátora je velmi složité určit, ke kterým procesům a jak v plazmatu dochází.
| << Předchozí (Úvod) | [Nahoru] | Další (Diagnostika plazmatu) >> |